vorgelegt von
angefertigt in der Abteilung Chemische Physik der Universität Ulm
im Zeitraum von August 1989 bis Juli 1990
1. Gutachter: Prof. Dr. H.-K. Bodenseh
2. Gutachter: Prof. Dr. H.A. Brune
Herrn Prof. Dr. H.-K. Bodenseh danke ich sehr herzlich, nicht nur für die interessante Aufgabenstellung, sondern auch für die ausgesprochen aufmerksame Betreuung und das angenehme Arbeitsklima.
Meinen Dank möchte ich auch Herrn Dipl.-Chem. Andreas Koch aussprechen, der mir bei der Einarbeitung in die Technik des Mikrowellenspektrometers hilfreich war, sowie Herrn Dipl.-Phys. Bernhard Reissenauer für seine Hilfsbereitschaft in Sachen Datenverarbeitung.
Ein ganz besonderes Dankeschön gilt Herrn Ziegler aus der Abteilung Organische Chemie I, der durch seine Bereitschaft, einige Kernresonanzspektren aufzunehmen, viel zur Überbrückung der Auftragsnotlage in der Sektion Kernresonanzspektroskopie beigetragen hat.
Weiterhin gilt mein Dank Herrn Dr. habil. M. Dakkouri, der mir nicht nur bei der Benutzung von GAUSSIAN 86 sehr hilfreich war, sondern auch durch die Bereitstellung einiger Laborgeräte einen erheblichen Beitrag zum Fortgang dieser Arbeit geleistet hat.
Auch Herrn Dipl.-Chem. Hans Lang möchte ich für seine stets offene Tür und seine Diskussionsbereitschaft in Sachen präparativer organischer Chemie dankend erwähnen.
Bedanken möchte ich mich auch bei Herrn Dr. G. Schmidtberg, der nicht nur einige Massenspektren aufgenommen, sondern auch wertvolle Hinweise zur Interpretation selbst aufgenommener Spektren gegeben hat.
Und nicht zuletzt gehört mein Dank meinem Herrn und Schöpfer, der mir die Fähigkeiten gegeben hat, mit denen ich diese Arbeit bestreiten konnte.- Danke!
Zusammenstellung der verwendeten Abkürzungen
1.1 Überblick und Aufgabenstellung
2.1 Definition des Begriffes
2.2 Arten der Tautomerie
2.3 Geschichte und Bedeutung der Keto-Enol-Tautomerie
2.4 Enolisierungsmechanismen und Gleichgewichtslage
2.4.1 Basenkatalyse
2.4.2 Säurekatalyse
2.4.3 Metallionenkatalyse
2.4.4 Weitere Aspekte
2.4.5 Kinetische Effekte
3.1 Vorgehensweise zur Darstellung des Cyclohexadienons
3.2 Syntheseplan zur Darstellung der Vorläuferverbindung
3.3 Vorbereitende Rechnungen
3.3.1 Abschätzung der voraussichtlichen Struktur durch semi-empirische Methoden
3.3.2 Quantenmechanische Grundlagen
3.3.3 Ab-initio-Rechnung für Cyclohexadienon
3.3.4 Vorausberechnung des zu erwartenden Spektrums
4.1 Cycloadditionen
4.1.1 Die Diels-Alder-Reaktion als Spezialfall einer Cycloaddition
4.1.2 Stereochemie der Cycloadditionen
4.1.3 Reversibilität der Cycloadditionen
4.2 Sigmatrope Reaktionen
5.1 Die Strahlungsquelle
5.2 Die Absorptionszelle
5.3 Detektion
5.3.1 Starkmodulation
5.3.2 Phasenempfindliche Gleichrichtung
5.3.3 Time-Averaging
5.4 Auswertung der Daten
6.1 Erster Versuch zur Darstellung von TMSO-CPCH (V: 1,4- Methano- 5-trimethylsilyloxy-1,4,5,8,9,10-hexahydronaphthalin)
6.2 Darstellung von CPCH (III: 1,4-Methano-1,4,5,8,9,10-hexahydronaphthalin) (nach [6])
6.3 Erster Versuch zur Oxidation von CPCH (III)
6.4 Oxidation von CPCH (III) zu CPCH-ol (IV: 1,4-Methano-5-hydroxy- 1,4,5,8,9,10- hexahydronaphthalin) (nach [13])
6.5 Darstellung von TMSO-CPCH (V: 1,4-Methano-5-trimethylsilyloxy-1,4,5,8,9,10- hexahydronaphthalin) (nach [5])
6.6 Hydrolyse von TMSO-CPCH (V) zu CPCH-ol (IV)
6.7 Oxidation von CPCH-ol (IV) zu CPCH-on (VI: 1,4-Methano-5-oxo- 1,4,5,8,9,10- hexahydronaphthalin)
6.8 Abschließende Bemerkungen zum präparativen Teil
7 Versuche zu Darstellung und Nachweis des Cyclohexadienons
7.1 Einleitende Überlegungen
7.2 Vorversuche zur Zersetzung
7.3 Kombination von Ofen, Meßzelle und Massenspektrometer
7.4 Versuche zum rotationsspektroskopischen Nachweis des Cyclohexadienons
7.4.1 Versuche ohne Inertgas
7.4.2 Versuche mit Inertgasstrom
7.4.3 Versuche über fraktionierende Sublimation
| AME | atomare Masseneinheit | ||
| AO | Atom-Orbital | ||
| BWO | Rückwärtswellenoszillator (backward wave oscillator) | ||
| CHN | Elementaranalyse für C, H und N | ||
| CNDO | quantenmechanisches Näherungsverfahren (complete neglect of differential overlap) | ||
| CPCH | 1,4-Methano-hexahydronaphthalin | ||
| CPU | Computer-Zentraleinheit (central processing unit) | ||
| DC | Dünnschicht-Chromatographie | ||
| d.Th. | Ausbeute in Prozent der Theorie | ||
| EI | Elektronenstoßionisation (electron impact) | ||
| esu | Elektrostatische Einheit (electrostatic unit) | ||
| FD | Feld-Desorption (Ionisierungsmethode in der Massenspektrometrie) | ||
| IR | Infrarot | ||
| MO | Molekül-Orbital | ||
| NMR | Kernresonanz (nuclear magnetic resonance) | ||
| PCC | Pyridinium-Chlorochromat | ||
| RDA | Retro-Diels-Alder | ||
| RHF | eingeschränkte Hartree-Fock-Methode (restricted Hartree-Fock) | ||
| rf | Retentionsindex (retention factor) | ||
| SCF | Methode des selbstkonsistenten Feldes (self-consistent-field) | ||
| STO | Orbitale aus Slater-Determinanten (Slater-type-orbitals) | ||
| THF | Tetrahydrofuran | ||
| TMS | Tetramethylsilan | ||
| TMSO | Tetramethylsilyloxy-Gruppe | ||
| UV | Ultraviolett | ||
| VIS | sichtbares Licht (visible) |
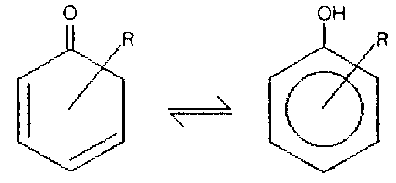
In den letzten Jahren sind auf dem Gebiet der Cyclohexadienone bereits einige Arbeiten durchgeführt worden. Das Interesse an dieser Verbindungsklasse hat vornehmlich zwei Gründe: zum einen kann man einige substituierte Cyclohexadienone als Keto-Tautomere der entsprechenden Phenole auffassen (Abb.1) und zweitens tauchen sie als reaktive Zwischenstufen in verschiedenen Reaktionen an Aromaten auf, bei denen sie auch Ende der 70er und Anfang der 80er Jahre postuliert und nachgewiesen worden sind [1]-[3]. Untersucht wurden hierbei zum Beispiel die Nitrierung [2] und Bromierung [3] von Phenolen, sowie die Oxidation von Toluol mit Sauerstoffatomen [1] (Abb.2).
Abb.1a: Tautomerie der Phenole. Hier als Beispiel ein 2,4-Cyclohexadienon.
Abb.1b: Die beiden Tautomeren des Phenols. 2,5- und
2,4-Cyclohexadienon.
Bei Verbindung I ist die in dieser Arbeit
verwendete Numerierung eingetragen.
Abb.2: Reaktionen mit Cyclohexadienonen als Zwischenstufen.
Oben: Nitrierung von Phenolen,
Mitte: Bromierung von Phenolen,
unten: Oxidation von Trideuterotoluol mit 3P-Sauerstoff (R1=H,D;
R2=D,H).
Die Klasse der Cyclohexadienone zeichnet sich weitgehend durch eine ausgeprägte Tendenz zur Umlagerung in die entsprechenden Phenole aus. Viele der Vertreter sind deshalb extrem instabil. Die Tendenz dieser Verbindungen zur Umlagerung ist meist so hoch, daß ihre Detektion bisher nur in solchen Fällen möglich war, in denen sperrige, elektronenschiebende Substituenten vorhanden sind. Auch ein chemisches Abfangen der Cyclohexadienone war aufgrund der schnellen Umlagerungen bisher nicht möglich.
Weiterhin konnten Cyclohexadienone isoliert werden, wenn eine Tautomerisierung infolge von Substitution der entsprechenden Wasserstoffatome nicht möglich war (zum Beispiel 2,5-Spirocyclohexadienone, bei denen beide 'para'- ständigen Wasserstoffe durch - zum Ring geschlossene - Kohlenwasserstoffreste ersetzt sind [8-10], oder geminal disubstituierte 2,4-Cyclohexadienone [11]).
Die unsubstituierten Grundverbindungen (I,II) wurden erstmals 1979 von Lasne, Ripoll und Denis [4] dargestellt und ihre IR- und UV/VIS-Spektren bei -196°C aufgenommen. 1986 untersuchten Shiner, Vorndam und Kass [5] die beiden Verbindungen erneut und bestimmten die Aciditäten in der Gasphase und die Bildungswärmen mit der flowing-afterglow-Technik.
In der vorliegenden Arbeit sollte nun versucht werden, die Synthese des 2,5-Cyclohexadienons in größerem Maßstab durchzuführen (Shiner, Vorndam und Kass stellten die Ausgangsverbindung nur in Zehntelgramm- Mengen her) und die bisher erreichten Ergebnisse durch die Beobachtung von Rotationsübergängen in einem Mikrowellenspektrometer zu ergänzen.